El cáncer de mama (CM) HER2-positivo es uno de los inmunofenotipos de CM que ha tenido mayores avances en las últimas dos décadas. Trastuzumab, un anticuerpo monoclonal humanizado dirigido selectivamente al dominio extracelular del receptor HER2 (1), fue el primer fármaco anti-HER aprobado por la FDA en septiembre de 1998 para el tratamiento de CM metastásico, y posteriormente como terapia adyuvante en 2006. (2) Desde entonces se ha continuado la investigación y desarrollo de nuevas terapias anti-HER. Actualmente contamos con 8 terapias anti-HER aprobadas por la FDA para CM avanzado. (3) En etapas tempranas disponemos de 4 fármacos con actividad anti-HER, todos con diferentes mecanismos de acción, pero con evidencia de beneficio en términos de supervivencia global (SG), supervivencia libre de enfermedad (SLE), supervivencia libre de enfermedad a distancia (SLED) como terapia neoadyuvante y tasas de respuesta patológica completa (RPc) en el contexto neoadyuvante (NA). (4)
En la actualidad, el tratamiento del CM HER2-positivo temprano debe ser personalizado y consensuado por un grupo de expertos, debido a la gama de posibilidades en relación con los fármacos de elección y a la secuencia del tratamiento (figura 1). De acuerdo con la etapa clínica y otros factores pronósticos, se considera iniciar tratamiento sistémico antes de la cirugía NA o posterior al procedimiento quirúrgico.
Tratamiento neoadyuvante
El tratamiento NA es el manejo inicial estándar para el CM inflamatorio y localmente avanzado. Sin embargo, en enfermedad temprana la NA se recomienda en inmunofenotipo HER2-positivo y triple negativo en caso de tumores >2 cm y/o en caso de ganglios positivos. (5) Esto fundamentado en un gran metaanálisis de 12 ensayos clínicos (ECs) y 11,955 pacientes que recibieron tratamiento NA, mostrando que la RPc se asociaba con un incremento en SG y SLE, siendo más evidente en los pacientes con inmunofenotipo HER2-positivo, donde, además, se alcanzaban tasas de RPc hasta del 50.3% si se utilizaba trastuzumab. (6)
Actualmente, disponemos de amplia evidencia de la eficacia del bloqueo HER2 en el escenario NA (tabla 1). Toda esta información se ha analizado en diferentes metaanálisis con conclusiones similares (7-10): el doble bloqueo HER2 con trastuzumab + pertuzumab (HP) en adición a un esquema de quimioterapia (QT) combinada, ha mostrado mayor tasa de RPc e impacto positivo en SLE, SLED y perfil de seguridad cardiaca, considerándose como el estándar de tratamiento actual. (5) Existen varias opciones para la selección del régimen de QT concomitante al bloqueo HER2, la elección puede basarse en el perfil de toxicidad, costos, disponibilidad en centros de infusión y la experiencia del médico tratante.
Las investigaciones actuales en el contexto NA están orientadas a evaluar el desescalamiento de la QT NA. En la Sociedad Estadounidense de Oncología Clínica 2021, se presentaron los resultados del ensayo clínico (EC) WSG-ADAPT HER2+/HR-, donde se evaluó el desescalamiento con HP +/- paclitaxel en pacientes con CM HER2-positivo RH-, reportando tasas de RPc del 34.4% para HP y del 90% para HP + paclitaxel. (11) Actualmente se encuentran en curso dos grandes ECs: CompassHER2-pCR (NCT04266249) (12) y DECRESCENDO (NCT04675827), (13) en los cuales se evaluará el desescalamiento del esquema NA a HP + paclitaxel seguido de HP adyuvante por un año en caso de RPc o T-DM1, en caso de enfermedad residual. Otra de las líneas de investigación abiertas en este contexto es el papel de las nuevas moléculas, actualmente se encuentran estudios corriendo con pyrotinib (NCT03756064, Pyramid NCT04900311). (14,15)
Tratamiento adyuvante postneoadyuvancia
RPc
El tratamiento posterior a la NA con tratamiento anti-HER2 dependerá de la repuesta patológica. En el caso de lograr una RPc, se deberá continuar con terapia anti-HER hasta completar 18 aplicaciones totales. En la mayoría de los estudios donde se evaluó la terapia NA, se continuó con trastuzumab monoterapia independientemente del tratamiento utilizado en la primera fase (tabla 1). Sin embargo, existe evidencia de que el tamaño tumoral (cT3-4) y la presencia de ganglios positivos al momento del diagnóstico siguen siendo factores de mal pronóstico independientemente de RPc. (16) Adicionalmente, un análisis conjunto de 6 ECs donde se utilizó NA con terapia anti-HER (monoterapia o combinada) y alcanzaron RPc con HP, reportó menores tasas de recurrencia en los pacientes que continuaron adyuvancia combinada con HP, comparado con trastuzumab (H) como monoterapia. (17) Por lo tanto, las recomendaciones actuales del consenso de St. Gallen sugieren continuar con doble bloqueo HER2 hasta completar 1 año en pacientes de alto riesgo al momento del diagnóstico. (18,19)
Enfermedad residual
En la búsqueda de mejorar el pronóstico de los pacientes con enfermedad residual, se desarrolló el EC fase III KATHERINE, donde se evaluó el uso de T-DM1 vs. trastuzumab como tratamiento adyuvante posterior a la NA y enfermedad residual, reportando una disminución del riesgo de recurrencia del 50%. (20)
En este mismo escenario se encuentran en investigación el papel de tucatinib, un TKI de tercera generación que mostró actividad en la enfermedad avanzada multitratada (COMPASSHER2-RD NCT04457596), (21) y otro anticuerpo conjugado, trastuzumab-deruxtecan (DESTINY-Breast 05 NCT04622319). (22)
Tratamiento adyuvante
Debido a que de manera inicial el tratamiento anti-HER2 se estudió en el entorno adyuvante, se cuenta con extensa evidencia del beneficio del bloqueo HER, monoterapia o combinado, en ese escenario (tabla 2). En contraste con el escenario NA, trastuzumab como monoterapia es el único agente que ha mostrado beneficio contundente en el escenario adyuvante en combinación de QT con o sin antraciclinas. (23-27) La adición de pertuzumab está reservada para casos con ganglios positivos, conforme a los resultados a largo plazo del EC APHINITY. (28)
En cuanto a los estadios I, las directrices internacionales recomiendan como tratamiento primario la cirugía y continuar el tratamiento adyuvante con paclitaxel + trastuzumab. (5, 29, 30) La base de esta recomendación se basa, en primer lugar, en la falta de inclusión de los tumores T1a y T1b en los ECs de adyuvancia (tabla 2) y por otro lado, en los resultados del EC fase II APT, donde el desescalamiento de la QT adyuvante con paclitaxel + trastuzumab en pacientes con CM HER2-positivo EC I mostró un riesgo de recurrencia a <2% a 3 años y 7% a 7 años. (31, 32) En cuanto a los T1c, existe controversia, ya que estos pacientes fueron incluidos tanto en los ECs APT (31) como en KATHERINE, y aunque existe un beneficio de la adición de T-DM1 en caso de tumor residual (20) , existirá la duda de un sobretratamiento en caso de lograr RPc. Cabe mencionar los recientes resultados del EC fase II ATEMPT, en el que se comparó el tratamiento estándar para CM ECI HER2-positivo con paclitaxel + trastuzumab vs. T-DM1 por 17 ciclos, son concordantes con los mostrados en el ensayo APT y sin diferencia entre los brazos para SLE en el seguimiento a 3.9 años, pero con un perfil de toxicidad distinto, postulándose como una alternativa de tratamiento. (33)
Duración de la terapia anti-HER
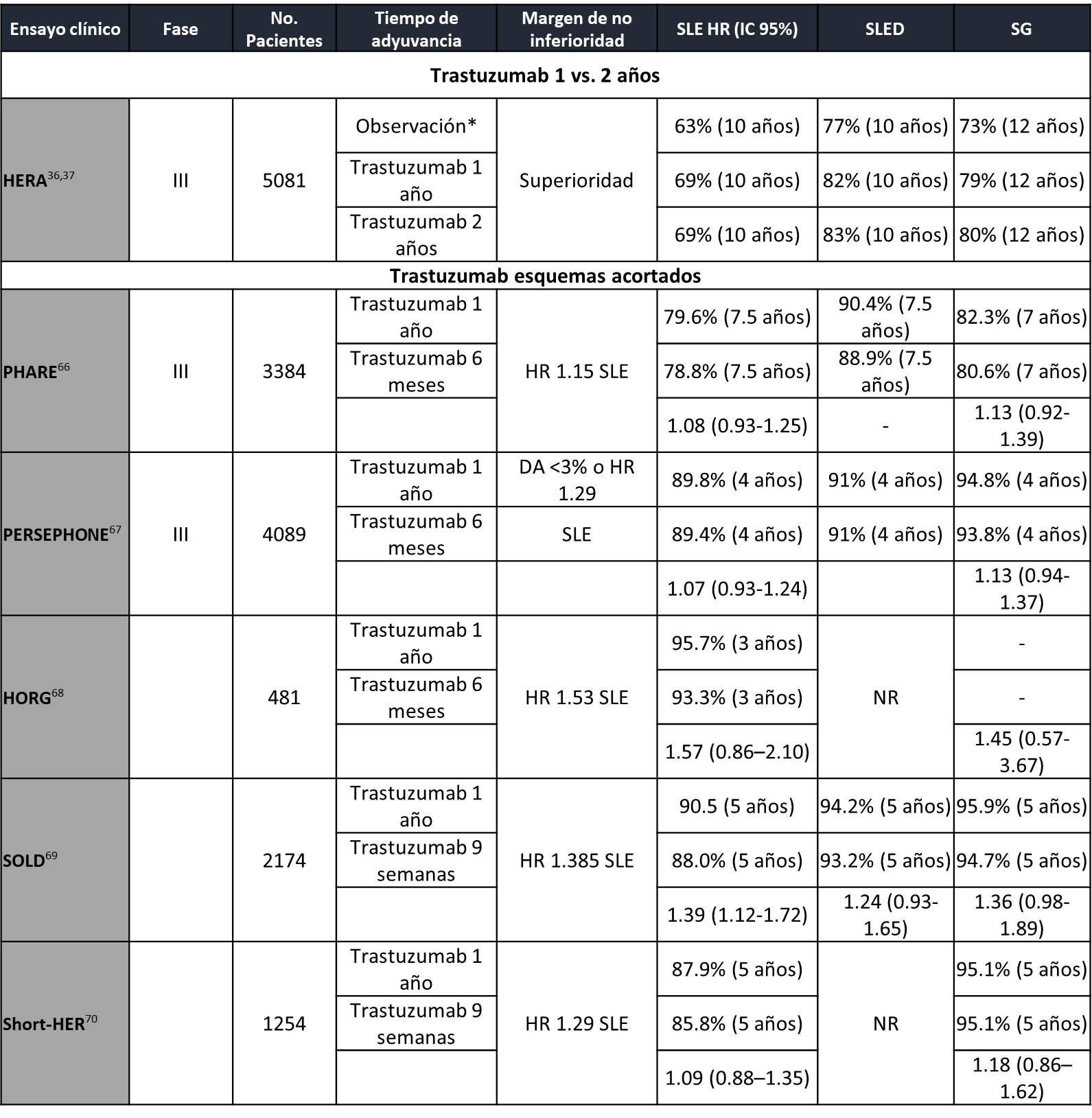
La duración del tratamiento anti-HER actualmente se considera de un año (29, 30), pero la decisión inicial de este periodo fue establecida de manera arbitraria. (34) Es por esto que surge la incertidumbre de la disminución o extensión del bloqueo HER2. Existen múltiples estudios donde se ha evaluado la reducción del tratamiento adyuvante con trastuzumab a 6 meses o incluso 9 semanas, todos ECs de no inferioridad, con margen de seguridad diferente y esquemas de tratamiento distintos, lo que hace complicada su comparación directa (tabla 3). Un reciente metaanálisis de 6 ECs aleatorizados y 11,376 pacientes concluyó, de manera general, que la adyuvancia por un año de trastuzumab mejora la SLE y SG, pero sugiere que esquemas cortos pueden ser no inferiores en pacientes de bajo riesgo (RH+ y ganglios negativos) y podría considerarse como opción en centros con recursos limitados o en toxicidad cardiaca. (35)
En cuanto a la extensión del bloqueo HER2, el EC HERA evaluó la duración de trastuzumab adyuvante 1 vs. 2 años sin lograr demostrar el beneficio de un esquema alargado (36, 37). En un contexto diferente, el EC fase III ExteNET estudió la adición de neratinib, un TKI pan-HER irreversible, después de terapia anti-HER2 NA estándar con trastuzumab, demostrando un beneficio de la adición de neratinib, pero restringido en el subgrupo de RH+ (SLE) y en RH+ y enfermedad residual (SLE y SG), con una toxicidad considerable, con una proporción de diarrea G3-4 que alcanzó un 40%. (38, 39) Las estrategias de escalamiento de dosis de neratinib y premedicación con loperamida han disminuido esta toxicidad. (40) Esta información podría ser suficiente para la adición de neratinib al tratamiento de pacientes con alto riesgo de recurrencia, sin embargo, se debe destacar que el tratamiento con pertuzumab NA y de T-DM1 en caso de enfermedad residual no era un estándar (38), lo que dificulta la incorporación de esta estrategia en los estándares de tratamiento actual.
Fig.1 Algoritmo para el manejo de CM temprano HER2-positivo de novo.
*Esquemas de quimioterapia: Doxorrubicina/epirrubicina + ciclofosfamida secuencial paclitaxel/docetaxel, carboplatino + docetaxel, carboplatino + paclitaxel,
+ 18 ciclos totales de trastuzumab +/- pertuzumab.
¶ 14 ciclos totales de T-DM1.
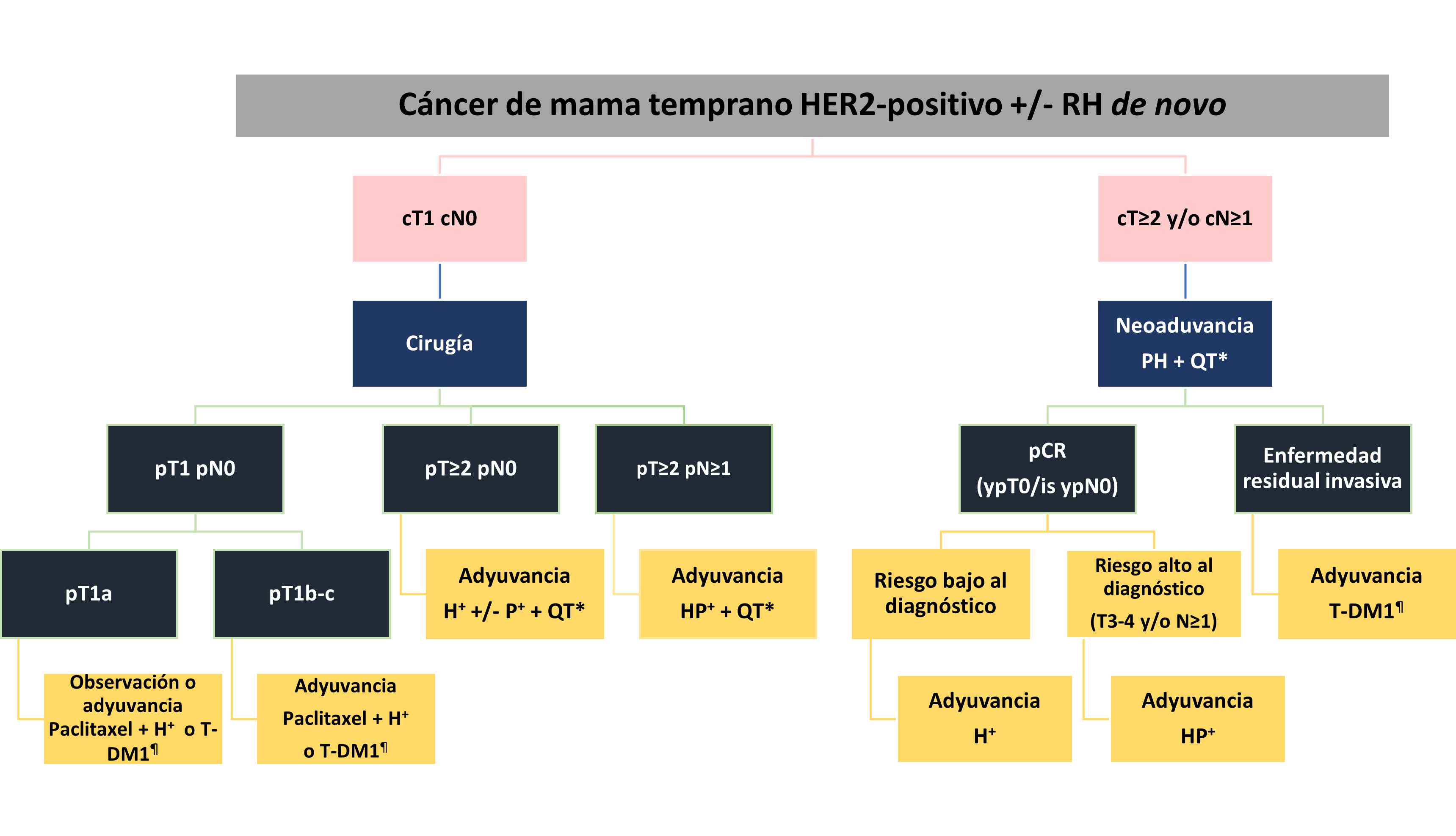
Tabla 1. Características de los principales ensayos clínicos con bloqueo HER2 y quimioterapia neoadyuvante.

Tabla 2. Características de principales ensayos clínicos con bloqueo HER2 y quimioterapia adyuvante.

Tabla 3. Características de principales ensayos clínicos que exploran duración de adyuvancia trastuzumab.
Abreviaturas:
CM: Cáncer de mama; SG: Supervivencia global; SLE: Supervivencia libre de enfermedad; SLED: Supervivencia libre de enfermedad a distancia, RPc: Respuesta patológica completa; NA: Neoadyuvante; ECs: Ensayos clínicos; HP: Trastuzumab + pertuzumab; EC: Ensayo clínico; RH+: Receptores hormonales positivos; ypT0 /is ypN0: Ausencia de cáncer invasivo en los ganglios de mama y axilares, independientemente del carcinoma ductal in situ; RH: Receptores hormonales; P: Pertuzumab; H: Trastuzumab; QT: Quimioterapia; AC: Doxorrubicina + ciclofosfamida; CMF: Ciclofosfamida-metotrexate-5FU; D: Docetaxel; DC: Docetaxel + carboplatino; DD: Dosis densas; EC: Epirrubicina + ciclofosfamida; FEC: Fluoracilo (5FU), epirrubicina-ciclofosfamida; K: Trastuzumab-emtansina; L: Lapatinib; LA: Localmente avanzado; NR: No reportado; SD: Sin diferencia; T: Paclitaxel; TC: Paclitaxel + carboplatino.
Referencias:
- Valabrega G, Montemurro F, Aglietta M. Trastuzumab: mechanism of action, resistance and future perspectives in HER2-overexpressing breast cancer. Ann Oncol Off J Eur Soc Med Oncol. 2007;18(6):977-984. doi:10.1093/annonc/mdl475.
- Cortazar P, Justice R, Johnson J, Sridhara R, Keegan P, Pazdur R. US Food and Drug Administration approval overview in metastatic breast cancer. J Clin Oncol. 2012;30(14):1705-1711. doi:10.1200/JCO.2011.39.2613.
- Cesca MG, Vian L, Cristóvão-Ferreira S, Pondé N, de Azambuja E. HER2-positive advanced breast cancer treatment in 2020. Cancer Treat Rev. 2020;88:102033. doi:10.1016/j.ctrv.2020.102033.
- Ban M, Petrić Miše B, Vrdoljak E. Early HER2-Positive Breast Cancer: Current Treatment and Novel Approaches. Breast Care. 2020;15(6):560-569. doi:10.1159/000511883.
- Korde LA, Somerfield MR, Carey LA, et al. Neoadjuvant Chemotherapy, Endocrine Therapy, and Targeted Therapy for Breast Cancer: ASCO Guideline. J Clin Oncol. 2021;39(13):1485-1505. doi:10.1200/JCO.20.03399.
- Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172. doi:10.1016/S0140-6736(13)62422-8.
- Wu D, Chen T, Jiang H, et al. Comparative Efficacy and Tolerability of Neoadjuvant Immunotherapy Regimens for Patients with HER2-Positive Breast Cancer: A Network Meta-Analysis. J Oncol. 2019;2019:1-14. doi:10.1155/2019/3406972.
- Chen S, Liang Y, Feng Z, Wang M. Efficacy and safety of HER2 inhibitors in combination with or without pertuzumab for HER2-positive breast cancer: a systematic review and meta-analysis. BMC Cancer. 2019;19(1):973. doi:10.1186/s12885-019-6132-0.
- Zhang J, Yu Y, Lin Y, et al. Efficacy and safety of neoadjuvant therapy for HER2-positive early breast cancer: a network meta-analysis. Ther Adv Med Oncol. 2021;13:175883592110069. doi:10.1177/17588359211006948.
- Debiasi M, Polanczyk CA, Ziegelmann P, et al. Efficacy of Anti-HER2 Agents in Combination With Adjuvant or Neoadjuvant Chemotherapy for Early and Locally Advanced HER2-Positive Breast Cancer Patients: A Network Meta-Analysis. Front Oncol. 2018;8. doi:10.3389/fonc.2018.00156.
- Harbeck N, Gluz O, Christgen M, et al. De-escalated neoadjuvant pertuzumab+trastuzumab with or without paclitaxel weekly in HR-/HER2+ early breast cancer: ADAPT-HR-/HER2+ biomarker and survival results. J Clin Oncol. 2021;39(15_suppl):503-503. doi:10.1200/JCO.2021.39.15_suppl.503.
- NCT04266249. CompassHER2-pCR: Decreasing Chemotherapy for Breast Cancer Patients After Pre-surgery Chemo and Targeted Therapy. Accessed August 14, 2021. https://clinicaltrials.gov/ct2/show/NCT04266249.
- NCT04675827. De-escalation Adjuvant Chemo in HER2+/ER-/Node-neg Early BC Patients Who Achieved pCR After Neoadjuvant Chemo & Dual HER2 Blockade (Decrescendo). Accessed August 14, 2021. https://clinicaltrials.gov/ct2/show/NCT04675827.
- NCT03756064. Neoadjuvant Study of Pyrotinib in Patients With HER2 Positive Breast Cancer. Accessed August 14, 2021. https://clinicaltrials.gov/ct2/show/NCT03756064.
- NCT04900311. Pyrotinib Versus Pertuzumab in Combination With Neoadjuvant Trastuzumab and Nab-Paclitaxel in HER2+ Early or Locally Advanced Breast Cancer (Pyramid). Accessed August 14, 2021. https://clinicaltrials.gov/ct2/show/NCT04900311?term=pyrotinib+neoadjuvant&cond=Breast+Cancer&draw=2&rank=5.
- Loibl S, Untch M, Buyse M, et al. Abstract P5-06-02: Pathologic complete response (pCR) and prognosis following neoadjuvant chemotherapy plus anti-HER2 therapy of HER2-positive early breast cancer (EBC). In: Poster Session Abstracts. American Association for Cancer Research; 2020:P5-06-02-P5-06-02. doi:10.1158/1538-7445.SABCS19-P5-06-02.
- Swain SM, Macharia H, Cortes J, et al. Abstract P1-18-01: Risk of recurrence and death in patients with early HER2-positive breast cancer who achieve a pathological complete response (pCR) after different types of HER2-targeted therapy: A retrospective exploratory analysis. In: Poster Session Abstracts. American Association for Cancer Research; 2020:P1-18-01-P1-18-01. doi:10.1158/1538-7445.SABCS19-P1-18-01.
- Burstein HJ, Curigliano G, Loibl S, et al. Estimating the benefits of therapy for early-stage breast cancer: the St. Gallen International Consensus Guidelines for the primary therapy of early breast cancer 2019. Ann Oncol. 2019;30(10):1541-1557. doi:10.1093/annonc/mdz235.
- Thomssen C, Balic M, Harbeck N, Gnant M. St. Gallen/Vienna 2021: A Brief Summary of the Consensus Discussion on Customizing Therapies for Women with Early Breast Cancer. Breast Care. 2021;16(2):135-143. doi:10.1159/000516114.
- von Minckwitz G, Huang C-S, Mano MS, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019;380(7):617-628. doi:10.1056/NEJMoa1814017.
- NCT04457596. T-DM1 and Tucatinib Compared With T-DM1 Alone in Preventing Relapses in People With High Risk HER2-Positive Breast Cancer, the CompassHER2 RD Trial. Accessed August 14, 2021. https://www.clinicaltrials.gov/ct2/show/NCT04457596.
- NCT04622319. A Study of Trastuzumab Deruxtecan (T-DXd) Versus Trastuzumab Emtansine (T-DM1) in High-risk HER2-positive Participants With Residual Invasive Breast Cancer Following Neoadjuvant Therapy (DESTINY-Breast05). Accessed August 14, 2021. https://www.clinicaltrials.gov/ct2/show/NCT04622319.
- Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus Adjuvant Chemotherapy for Operable HER2-Positive Breast Cancer. N Engl J Med. 2005;353(16):1673-1684. doi:10.1056/NEJMoa052122.
- Perez EA, Romond EH, Suman VJ, et al. Four-Year Follow-Up of Trastuzumab Plus Adjuvant Chemotherapy for Operable Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Joint Analysis of Data From NCCTG N9831 and NSABP B-31. J Clin Oncol. 2011;29(25):3366-3373. doi:10.1200/JCO.2011.35.0868.
- Perez EA, Romond EH, Suman VJ, et al. Trastuzumab Plus Adjuvant Chemotherapy for Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Planned Joint Analysis of Overall Survival From NSABP B-31 and NCCTG N9831. J Clin Oncol. 2014;32(33):3744-3752. doi:10.1200/JCO.2014.55.5730.
- Joensuu H, Bono P, Kataja V, et al. Fluorouracil, Epirubicin, and Cyclophosphamide With Either Docetaxel or Vinorelbine, With or Without Trastuzumab, As Adjuvant Treatments of Breast Cancer: Final Results of the FinHer Trial. J Clin Oncol. 2009;27(34):5685-5692. doi:10.1200/JCO.2008.21.4577.
- Slamon D, Eiermann W, Robert N, et al. Adjuvant Trastuzumab in HER2-Positive Breast Cancer. N Engl J Med. 2011;365(14):1273-1283. doi:10.1056/NEJMoa0910383.
- Piccart M, Procter M, Fumagalli D, et al. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer in the APHINITY Trial: 6 Years’ Follow-Up. J Clin Oncol. 2021;39(13):1448-1457. doi:10.1200/JCO.20.01204.
- National Comprehensive Cancer Network (NCCN): NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®): Breast Cancer. Version 5.2021, 2021. https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
- Cardoso F, Kyriakides S, Ohno S, et al. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019;30(8):1194-1220. doi:10.1093/annonc/mdz173.
- Tolaney SM, Barry WT, Dang CT, et al. Adjuvant Paclitaxel and Trastuzumab for Node-Negative, HER2-Positive Breast Cancer. N Engl J Med. 2015;372(2):134-141. doi:10.1056/NEJMoa1406281.
- Tolaney SM, Guo H, Pernas S, et al. Seven-Year Follow-Up Analysis of Adjuvant Paclitaxel and Trastuzumab Trial for Node-Negative, Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer. J Clin Oncol. 2019;37(22):1868-1875. doi:10.1200/JCO.19.00066.
- Tolaney SM, Tayob N, Dang C, et al. Adjuvant Trastuzumab Emtansine Versus Paclitaxel in Combination With Trastuzumab for Stage I HER2-Positive Breast Cancer (ATEMPT): A Randomized Clinical Trial. J Clin Oncol. 2021;39(21):2375-2385. doi:10.1200/JCO.20.03398.
- Pernas S, Barroso‐Sousa R, Tolaney SM. Optimal treatment of early stage HER2‐positive breast cancer. Cancer. 2018;124(23):4455-4466. doi:10.1002/cncr.31657.
- Gulia S, Kannan S, Badwe R, Gupta S. Evaluation of 1-Year vs Shorter Durations of Adjuvant Trastuzumab Among Patients With Early Breast Cancer. JAMA Netw Open. 2020;3(8):e2011777. doi:10.1001/jamanetworkopen.2020.11777.
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al. Trastuzumab after Adjuvant Chemotherapy in HER2-Positive Breast Cancer. N Engl J Med. 2005;353(16):1659-1672. doi:10.1056/NEJMoa052306.
- Cameron D, Piccart-Gebhart MJ, Gelber RD, et al. 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet. 2017;389(10075):1195-1205. doi:10.1016/S0140-6736(16)32616-2.
- Martin M, Holmes FA, Ejlertsen B, et al. Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(12):1688-1700. doi:10.1016/S1470-2045(17)30717-9.
- Chan A, Moy B, Mansi J, et al. Final Efficacy Results of Neratinib in HER2-positive Hormone Receptor-positive Early-stage Breast Cancer From the Phase III ExteNET Trial. Clin Breast Cancer. 2021;21(1):80-91.e7. doi:10.1016/j.clbc.2020.09.014.
- Ruiz-Borrego M, Chan A, Marx G, et al. Abstract PS13-20: Bringing diarrhea under CONTROL: Dose escalation reduces neratinib-associated diarrhea and improves tolerability in HER2-positive early-stage breast cancer. In: Poster Session Abstracts. American Association for Cancer Research; 2021:PS13-20-PS13-20. doi:10.1158/1538-7445.SABCS20-PS13-20.
- Buzdar AU, Valero V, Ibrahim NK, et al. Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil, epirubicin, and cyclophosphamide chemotherapy and concurrent trastuzumab in human epidermal growth factor receptor 2-positive operable breast cancer: an update of the initial randomized study. Clin Cancer Res. 2007;13(1):228-233. doi:10.1158/1078-0432.CCR-06-1345.
- Buzdar AU, Suman VJ, Meric-Bernstam F, et al. Fluorouracil, epirubicin, and cyclophosphamide (FEC-75) followed by paclitaxel plus trastuzumab versus paclitaxel plus trastuzumab followed by FEC-75 plus trastuzumab as neoadjuvant treatment for patients with HER2-positive breast cancer (Z1041): a random. Lancet Oncol. 2013;14(13):1317-1325. doi:10.1016/S1470-2045(13)70502-3.
- Buzdar AU, Suman VJ, Meric-Bernstam F, et al. Disease-Free and Overall Survival Among Patients With Operable HER2-Positive Breast Cancer Treated With Sequential vs Concurrent Chemotherapy. JAMA Oncol. 2019;5(1):45. doi:10.1001/jamaoncol.2018.3691.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER. Lancet. 2010;375(9712):377-384. doi:10.1016/S0140-6736(09)61964-4.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet Oncol. 2014;15(6):640-647. doi:10.1016/S1470-2045(14)70080-4.
- Gianni L, Pienkowski T, Im Y-H, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012;13(1):25-32. doi:10.1016/S1470-2045(11)70336-9.
- Gianni L, Pienkowski T, Im Y-H, et al. 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial. Lancet Oncol. 2016;17(6):791-800. doi:10.1016/S1470-2045(16)00163-7.
- Schneeweiss A, Chia S, Hickish T, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol. 2013;24(9):2278-2284. doi:10.1093/annonc/mdt182.
- Schneeweiss A, Chia S, Hickish T, et al. Long-term efficacy analysis of the randomised, phase II TRYPHAENA cardiac safety study: Evaluating pertuzumab and trastuzumab plus standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive ea. Eur J Cancer. 2018;89:27-35. doi:10.1016/j.ejca.2017.10.021.
- Nitz UA, Gluz O, Christgen M, et al. De-escalation strategies in HER2-positive early breast cancer (EBC): final analysis of the WSG-ADAPT HER2+/HR− phase II trial: efficacy, safety, and predictive markers for 12 weeks of neoadjuvant dual blockade with trastuzumab and pertuzumab ± weekly pacl. Ann Oncol. 2017;28(11):2768-2772. doi:10.1093/annonc/mdx494.
- van der Voort A, van Ramshorst MS, van Werkhoven ED, et al. Three-Year Follow-up of Neoadjuvant Chemotherapy With or Without Anthracyclines in the Presence of Dual ERBB2 Blockade in Patients With ERBB2 -Positive Breast Cancer. JAMA Oncol. 2021;7(7):978. doi:10.1001/jamaoncol.2021.1371.
- Dang C, Ewer MS, Delaloge S, et al. 43O Pertuzumab/trastuzumab in early stage HER2-positive breast cancer: 5-year and final analysis of the BERENICE trial. Ann Oncol. 2021;32:S38-S39. doi:10.1016/j.annonc.2021.03.057.
- Hurvitz SA, Martin M, Jung KH, et al. Neoadjuvant Trastuzumab Emtansine and Pertuzumab in Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Three-Year Outcomes From the Phase III KRISTINE Study. J Clin Oncol. 2019;37(25):2206-2216. doi:10.1200/JCO.19.00882.
- DeMichele AM, Moulder S, Buxton M, et al. Abstract CT042: Efficacy of T-DM1+pertuzumab over standard therapy for HER2+ breast cancer: Results from the neoadjuvant I-SPY 2 TRIAL. In: Clinical Trials. American Association for Cancer Research; 2016:CT042-CT042. doi:10.1158/1538-7445.AM2016-CT042.
- Untch M, Loibl S, Bischoff J, et al. Lapatinib versus trastuzumab in combination with neoadjuvant anthracycline-taxane-based chemotherapy (GeparQuinto, GBG 44): a randomised phase 3 trial. Lancet Oncol. 2012;13(2):135-144. doi:10.1016/S1470-2045(11)70397-7.
- Untch M, von Minckwitz G, Gerber B, et al. Survival Analysis After Neoadjuvant Chemotherapy With Trastuzumab or Lapatinib in Patients With Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer in the GeparQuinto (G5) Study (GBG 44). J Clin Oncol. 2018;36(13):1308-1316. doi:10.1200/JCO.2017.75.9175.
- Baselga J, Bradbury I, Eidtmann H, et al. Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): a randomised, open-label, multicentre, phase 3 trial. Lancet. 2012;379(9816):633-640. doi:10.1016/S0140-6736(11)61847-3.
- Huober J, Holmes E, Baselga J, et al. Survival outcomes of the NeoALTTO study (BIG 1–06): updated results of a randomised multicenter phase III neoadjuvant clinical trial in patients with HER2-positive primary breast cancer. Eur J Cancer. 2019;118:169-177. doi:10.1016/j.ejca.2019.04.038.
- Robidoux A, Tang G, Rastogi P, et al. Lapatinib as a component of neoadjuvant therapy for HER2-positive operable breast cancer (NSABP protocol B-41): an open-label, randomised phase 3 trial. Lancet Oncol. 2013;14(12):1183-1192. doi:10.1016/S1470-2045(13)70411-X.
- Robidoux A, Tang G, Rastogi P, et al. Evaluation of lapatinib as a component of neoadjuvant therapy for HER2+ operable breast cancer: 5-year outcomes of NSABP protocol B-41. J Clin Oncol. 2016;34(15_suppl):501-501. doi:10.1200/JCO.2016.34.15_suppl.501.
- Fernandez-Martinez A, Krop IE, Hillman DW, et al. Survival, Pathologic Response, and Genomics in CALGB 40601 (Alliance), a Neoadjuvant Phase III Trial of Paclitaxel-Trastuzumab With or Without Lapatinib in HER2-Positive Breast Cancer. J Clin Oncol. 2020;38(35):4184-4193. doi:10.1200/JCO.20.01276.
- Slamon D, Eiermann W, Robert N, et al. Abstract S5-04: Ten year follow-up of BCIRG-006 comparing doxorubicin plus cyclophosphamide followed by docetaxel (AC→T) with doxorubicin plus cyclophosphamide followed by docetaxel and trastuzumab (AC→TH) with docetaxel, carboplatin and trastuzumab (TCH). In: General Session Abstracts. American Association for Cancer Research; 2016:S5-04-S5-04. doi:10.1158/1538-7445.SABCS15-S5-04.
- Harbeck N, Im S-A, Barrios CH, et al. Primary analysis of KAITLIN: A phase III study of trastuzumab emtansine (T-DM1) + pertuzumab versus trastuzumab + pertuzumab + taxane, after anthracyclines as adjuvant therapy for high-risk HER2-positive early breast cancer (EBC). J Clin Oncol. 2020;38(15_suppl):500-500. doi:10.1200/JCO.2020.38.15_suppl.500.
- Goss PE, Smith IE, O’Shaughnessy J, et al. Adjuvant lapatinib for women with early-stage HER2-positive breast cancer: a randomised, controlled, phase 3 trial. Lancet Oncol. 2013;14(1):88-96. doi:10.1016/S1470-2045(12)70508-9.
- Piccart-Gebhart M, Holmes E, Baselga J, et al. Adjuvant Lapatinib and Trastuzumab for Early Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Results From the Randomized Phase III Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization Trial. J Clin Oncol. 2016;34(10):1034-1042. doi:10.1200/JCO.2015.62.1797.
- Pivot X, Romieu G, Debled M, et al. 6 months versus 12 months of adjuvant trastuzumab in early breast cancer (PHARE): final analysis of a multicentre, open-label, phase 3 randomised trial. Lancet. 2019;393(10191):2591-2598. doi:10.1016/S0140-6736(19)30653-1.
- Earl HM, Hiller L, Vallier A-L, et al. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet. 2019;393(10191):2599-2612. doi:10.1016/S0140-6736(19)30650-6.
- Mavroudis D, Saloustros E, Malamos N, et al. Six versus 12 months of adjuvant trastuzumab in combination with dose-dense chemotherapy for women with HER2-positive breast cancer: a multicenter randomized study by the Hellenic Oncology Research Group (HORG). Ann Oncol. 2015;26(7):1333-1340. doi:10.1093/annonc/mdv213.
- Joensuu H, Fraser J, Wildiers H, et al. Effect of Adjuvant Trastuzumab for a Duration of 9 Weeks vs 1 Year With Concomitant Chemotherapy for Early Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer. JAMA Oncol. 2018;4(9):1199. doi:10.1001/jamaoncol.2018.1380.
- Conte PF, Frassoldati A, Bisagni G, et al. 41O Nine weeks vs 1-year adjuvant trastuzumab: Long term outcomes of the ShortHER randomised trial. Ann Oncol. 2021;32:S37. doi:10.1016/j.annonc.2021.03.055.
Dra. Cynthia Villareal Garza
Oncólogo Médico
Monterrey, Nuevo León, México
Dra. Daniela Vázquez Juárez
Oncólogo Médico
Monterrey, Nuevo León, México
Código de aprobación: M-MX-00003163.
Gracias al apoyo educativo de Roche México.
Cáncer de mamaHER2 positivoneratinibpaclitaxelpertuzumabTrastuzumabtrastuzumab deruxtecan




