
Introducción
El cáncer es hoy la primera causa de muerte en Occidente. Es un problema en constante aumento en la vejez, debido fundamentalmente al aumento en la expectativa media de vida en los países del primer mundo y en menor medida en los demás. En el desarrollo del cáncer en el anciano hay que tener en cuenta el grado de crecimiento del tumor, la mayor susceptibilidad de los tejidos a los carcinógenos ambientales y los cambios en el organismo que favorecen la formación y progresión del cáncer.
Se tratarán las características epidemiológicas, moleculares y fisiológicas de las neoplasias en el individuo mayor de 65 años. Se señalarán aspectos sobre la prevención y se describirán las técnicas de evaluación del paciente con cáncer para realizar un enfoque terapéutico adaptado a cada individuo.
Epidemiología
La edad promedio para el diagnóstico del cáncer en los países desarrollados se aproxima a los 70 años y cada vez son más las personas afectadas debido a que este segmento de la población es el de más rápido crecimiento. Las proyecciones en los Estados Unidos indican que para el año 2030 el 70% de las neoplasias ocurrirá en personas de 65 o más años (fig. 1) (Edwards, B K, et al., 2020).
Figura 1.

Los ancianos constituyen un grupo especial en relación con el cáncer porque sobre ellos recae la mayor incidencia de neoplasias, tal es así que las personas mayores de 65 años constituyen sólo el 13% de la población, pero soportan el 60% de las neoplasias malignas y casi el 70% de todas las muertes por cáncer (Hodgson NA, 2002). La fig. 2 muestra el porcentaje de los distintos tipos de cáncer en las personas mayores de 65 años para ambos sexos en la República Argentina.
Todos los tipos de cáncer aumentan a medida que transcurren los años, pero no lo hacen de forma homogénea y además hay variaciones relacionadas al sexo. De tal manera que en el hombre el cáncer de próstata es el que más aumenta en frecuencia desde los 65 hasta los 85 años, pasando de 100 por 100,000 a 700 por 100,000 hombres, respectivamente, mientras que los demás tumores lo hacen de una forma más escalonada. En la mujer el cáncer que más aumenta en frecuencia de los 65 a los 85 años es el de colon y recto, pasando de 80 por 100,000 a 300 por 100,000, respectivamente (Edwards BK, 2002).
Figura 2. Incidencia de los distintos tipos de neoplasias en hombres y mujeres mayores de 65 años en la República Argentina.

Factores inherentes a la edad que afectan el pronóstico y la evolución de las neoplasias
Patologías asociadas
Es importante señalar que los pacientes mayores de 65 años presentan una serie de patologías asociadas que contribuyen a aumentar la mortalidad por cáncer. La tabla 1 señala las morbilidades asociadas más comunes en el anciano (Yancik R, et al., 2016).
Tabla 1. Las 10 enfermedades subyacentes más comunes en individuos >65 años que aumentan la morbimortalidad del paciente con cáncer aumentan la morbimortalidad del paciente con cáncer
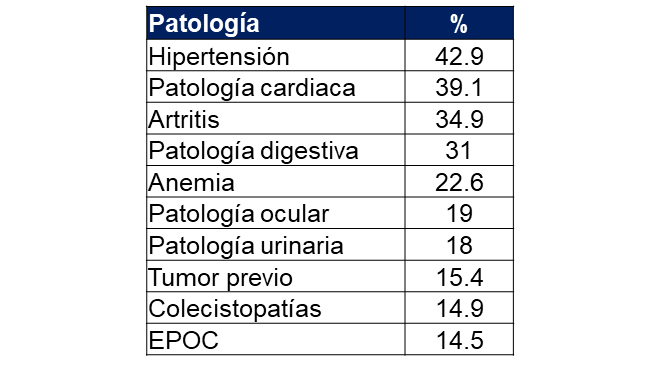
*EPOC: Enfermedad pulmonar obstructiva crónica.
De todas estas patologías asociadas merece destacar la anemia, ya que en los últimos años los estudios demostraron que está relacionada con menor supervivencia, mayor dependencia funcional, disnea y un riesgo aumentado de complicaciones terapéuticas (Balducci L, et al., 2003, 2005; Beghe C, et al., 2004).
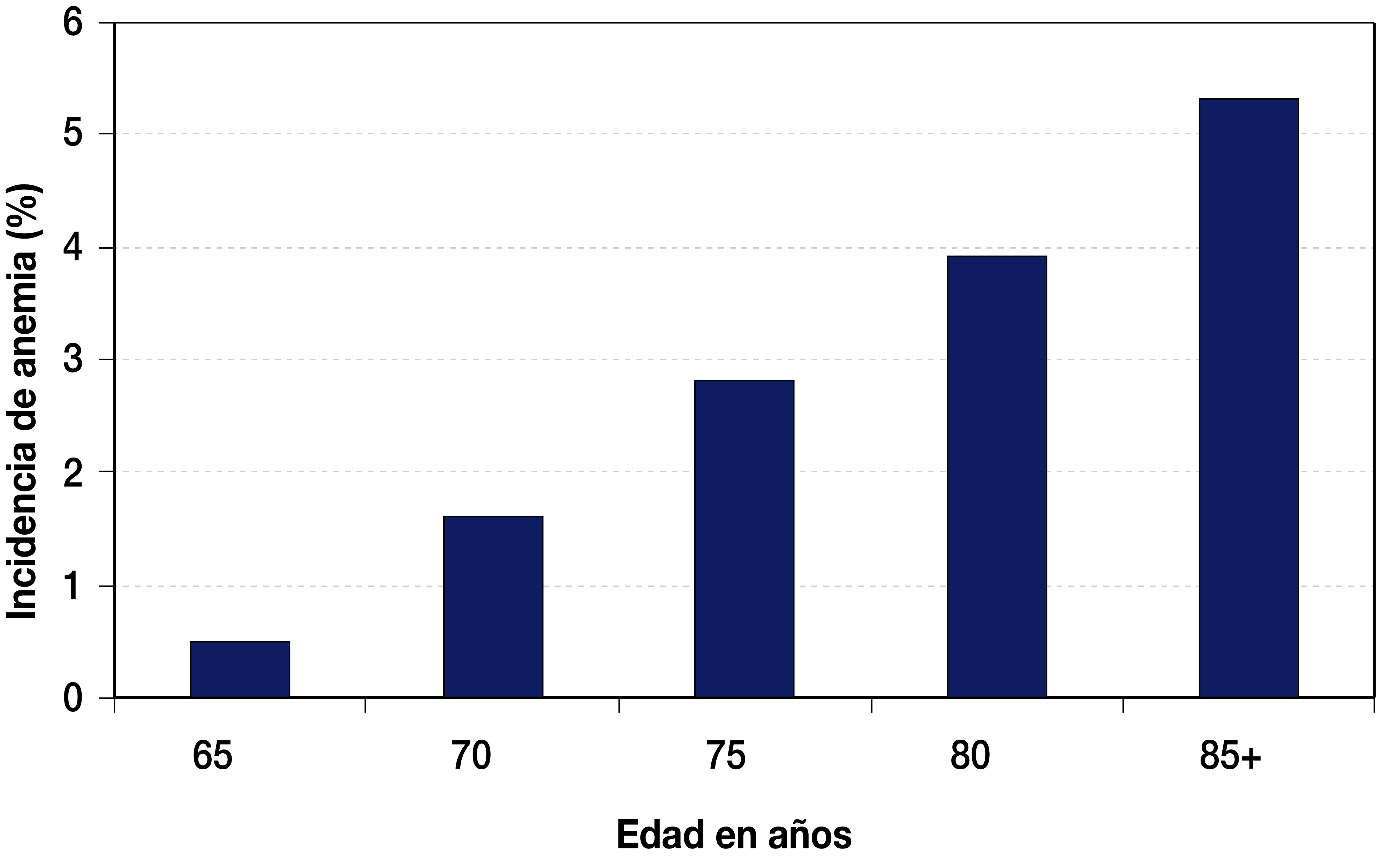
Normalmente hay una tendencia hacia la anemia durante el envejecimiento, aún en personas sanas (fig. 3) (Ani BJ, et al., 1994). Esto no se debe a una declinación de las células madre pluripotenciales, puesto que no parecen afectarse en cantidad con el paso del tiempo (Balducci L, et al., 2016). La hipótesis actualmente más aceptada es que el envejecimiento está asociado con un aumento de citosinas, particularmente la interleucina-6 (IL-6), que afectan la respuesta de las células madre hematopoyéticas ante los factores de crecimiento (Ershler WB, 2013).
Otras causas de anemia en el anciano son patologías asociadas, particularmente la insuficiencia renal crónica y el déficit de aporte de vitamina B12. Por lo general, muchos ancianos no se alimentan bien, debido a pérdida de piezas dentarias y también a carencias económicas. Todos estos mecanismos son independientes de la anemia aplásica, que es un proceso autoinmune asociado con la inhibición de la maduración y la proliferación de las células hematopoyéticas.
En el anciano con cáncer se agrega, además, la supresión de la actividad de la médula ósea por la quimioterapia o a la radioterapia. El tratamiento de la anemia será desarrollado en el capítulo de tratamiento y manejo del anciano con cáncer.
Figura 3.
Cambios moleculares por el envejecimiento
‘‘In vitro’’ el envejecimiento celular se asocia con cambios moleculares, algunos de los cuales pueden ser favorables y otros no, como las mutaciones, la hipermetilación del ADN y la formación de aductos de ADN. Un aducto es un complejo que se forma cuando un compuesto químico se une a una molécula biológica, como ADN o proteínas (Careca I, et al.. 2015).
Estos cambios moleculares son comunes en el envejecimiento celular y semejan los cambios moleculares de la carcinogénesis, que llevan a la activación de oncogenes y a la supresión de los genes antiproliferativos o antioncogenes. De esta manera, las células envejecidas son más susceptibles que las células jóvenes a los efectos de la fase tardía de los carcinógenos (promotores).
Los cambios que se oponen a la carcinogénesis son la reducción progresiva de la longitud del telómero y de la actividad de la telomerasa, así como la activación del gen P14 que codifica a un inhibidor de la quinasa dependiente de la ciclina y, por lo tanto, se opone a la proliferación celular (Collins K, 2019; Liggett WH, et al. 2019).
El telómero está situado en los extremos del cromosoma al cual protege de la degradación. Previamente a la división celular, la célula duplica su ADN, incluida la secuencia de bases que constituyen el telómero. Sin embargo, en una célula normal, la maquinaria de replicación no es capaz de copiar la totalidad de la secuencia del telómero en una de las hebras del ADN del cromosoma y, como resultado, el telómero se hace cada vez más corto en cada replicación. El desgaste del telómero con la sucesión de ciclos celulares impide su función protectora, por lo que el cromosoma se hace inestable, originando errores en la división que llevan a la aparición de diversos tipos de mutaciones. Las células que presentan estos defectos no solo son incapaces de duplicarse, sino que dejan de ser viables, activándose los procesos de apoptosis o muerte celular programada. El desgaste del telómero limita la duración del ciclo vital celular de la mayoría de los tipos de células, excepto las células germinales y embrionarias, que poseen la enzima telomerasa capaz de restaurar la secuencia del telómero (Banks D, et al., 2017). La disfunción del telómero, incluyendo el acortamiento de su longitud o cambios estructurales, demostró que contribuye al cáncer y al envejecimiento.
En el anciano, el funcionamiento de los telómeros y la telomerasa se encuentra alterado (Sharpless NE, et al., 2004). Se ha detectado que más del 80% de todos los cánceres tienen un aumento de la actividad de la telomerasa. Esto se debe a varios mecanismos, entre ellos la mayor expresión de la transcriptasa inversa de la telomerasa humana (hTERT, por sus siglas en inglés) que aumenta la actividad de la telomerasa. Otro de los mecanismos es la reducción del factor 2 de unión a las repeticiones telomérica (TRF2, por sus siglas en inglés), que es una proteína de unión del ADN en secuencias específicas y que protege a los telómeros (Gu J, 2015).
El envejecimiento también produce menor expresión del gen p53, que normalmente regula el ciclo de la célula y protege su genoma. Cuando la disponibilidad del gen p53 está limitada, se producen mutaciones múltiples que predisponen al cáncer (Sharpless NE, et al., 2012).
Importancia de los procesos inflamatorios en la vejez
El fenómeno inflamatorio participa en muchos aspectos del envejecimiento, de hecho, el envejecimiento está asociado con cierto grado de actividad inflamatoria que conduce, a lo largo del tiempo, a un daño tisular (Bruunsgard H, et al., 2011).
La relación entre el mecanismo de la carcinogénesis y la inflamación ha sido señalada desde hace varias décadas. Los tumores tienen un microambiente inflamatorio caracterizado por la presencia de leucocitos tanto en el estroma que rodea al tumor como en la zona tumoral (Lakwill F, et al., 2011). Las células inflamatorias y las citosinas halladas en los tumores contribuyen al crecimiento y a la inmunosupresión del tumor, lo que permite desarrollar una respuesta antitumoral eficaz por parte del huésped. Sin embargo, la susceptibilidad al cáncer, que en la vejez está aumentada, podría estar asociada con polimorfismos de los genes de la citosina, especialmente los de la IL-6.
Las citosinas son proteínas segregadas principalmente por las células del sistema inmunitario y alteran el comportamiento de la propia célula que la produce o el de otra célula. Las citosinas cuyo polimorfismo parece estar relacionado con la tumorigénesis son la IL-10 y la IL-6. Como en general las citosinas ejercen diversos tipos de estímulos, la interrelación entre estas moléculas y el cáncer es variable. En el caso de la IL-10, se observó que altos valores de esta proteína son promotores de tumor y suelen estar elevadas en varios tipos de tumores sólidos (Dummer W, et al., 2015). Por otro lado, la IL-10 bloquea la capacidad de los monocitos/macrófagos y de las células dendríticas para actuar como células presentadoras de antígenos. Por lo tanto, la principal función de la IL-10 sería la de limitar y terminar la señal inflamatoria. Este fenómeno haría que las células killer produzcan la lisis y el control del tumor. Sin embargo, los resultados de las investigaciones sobre los mecanismos genéticos tumorales, en los cuales están involucrados los agentes infecciosos, demostraron que una alta producción del genotipo de IL-10 sería perjudicial, mientras que puede resultar favorable contra tumores sólidos, como el de mama y el de próstata (Calogero C, et al., 2014).
Se sabe que, al inicio de una inflamación, la IL-6 actúa como mediadora de la fase aguda. Si la actividad de la IL-6 persiste, la inflamación aguda se transforma en crónica y la citosina mantiene la supervivencia y crecimiento de los linfocitos y las células mieloides, que a su vez aumentan los niveles de IL-6, creándose de esta manera un círculo vicioso (Ishihara K, et al., 2012).
Los estudios experimentales sugieren que la IL-6 actúa como un potente estimulador de metástasis a través del aumento de expresión de las moléculas de adhesión por parte de las células endoteliales y por la producción del factor de crecimiento del endotelio vascular (VEGF, por sus siglas en inglés). Los niveles elevados de IL-6 están asociados con estados avanzados y pronósticos desfavorables en varios tipos de cáncer, incluyendo el de mama y el de colon y recto (Belluco C, et al., 2013).
Daño al ADN por radicales libres
La generación de radicales libres o especies reactivas del oxígeno (ERO) es una consecuencia del metabolismo celular aeróbico. Cuando en un tejido la producción de ERO supera a las defensas antioxidantes se crea una situación de estrés oxidativo que afecta al material genético. Debido a que varias condiciones que son fuertes generadoras de ERO también son cancerígenas (tabaquismo, xenobióticos, inflamaciones crónicas, radiación UV), muchas líneas de investigación sostienen la hipótesis de las ERO como promotoras de cáncer (Valko M, et al., 2014).
La modificación permanente del material genético por acción de las ERO representa el primer paso en la carcinogénesis relacionada con la mutagénesis y el envejecimiento (Halliwell B, et al., 2019). Las alteraciones del ADN causadas por las ERO son eliminadas por diversos mecanismos de reparación, la mayoría de los cuales se efectúan mediante la escisión o corte del segmento afectado. Sin embargo, la reparación incompleta o defectuosa del ADN puede producir mutaciones, como la eliminación o sustitución de bases que conducen a la carcinogénesis. Este potencial mutagénico es directamente proporcional al número de bases oxidadas del ADN que escapan a los procesos de reparación, los cuales decaen con el transcurso de los años (Marnett LJ, 2020).
Se consideran dos mecanismos implicados en la carcinogénesis por las ERO. El primer mecanismo es por la modulación de expresión de genes que activan señales de crecimiento y proliferación, lo cual conduce a la promoción del tumor; también se pueden afectar genes supresores de tumores como es el p53 (Szymanska K,et al., 2013). En el segundo mecanismo las ERO inducen diversas alteraciones cromosómicas que bloquean la replicación del ADN y aumentan la citotoxicidad (Valko M, et al., 2004). Las ERO pueden actuar oxidando directamente las bases del ADN o indirectamente a través de biomoléculas oxidadas por las mismas ERO, como son los lipoperóxidos y el malondialdehído, ambos productos de la oxidación de los ácidos grasos de las membranas celulares y de las lipoproteínas (Tang DG, et al., 2002).
Existen numerosos métodos para evaluar el daño oxidativo al ADN. Uno de los más divulgados es la oxidación de la base guanina (8-oxoG) y está considerado como un marcador de carcinogénesis (Bruner SD, et al., 2000).
Distintos comportamientos de algunos tumores en el geronte
Las características biológicas de algunos tumores cambian con la edad, aspecto que está detallado en la tabla 2, donde se observa que algunos tumores son más agresivos en los ancianos que en personas más jóvenes.
Tabla 2. Modificaciones biológicas de algunas neoplasias relacionadas con la edad

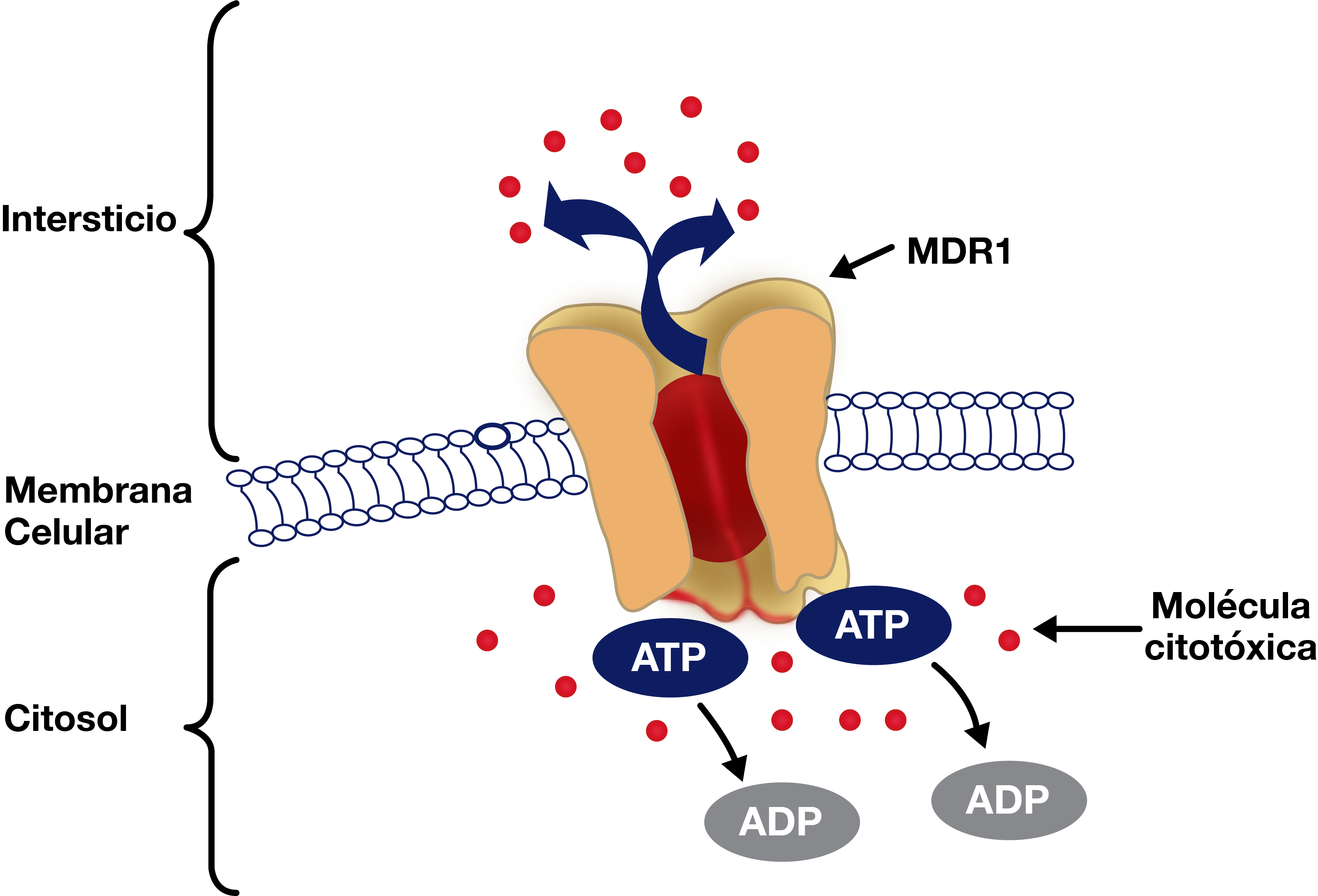
El fenómeno de resistencia a los tumores ante distintos agentes constituye un formidable desafío en el terreno de la oncología. Esta resistencia puede observarse en el momento del diagnóstico o adquirirse después de un tratamiento seguido de recidiva del tumor. Si bien los mecanismos que producen resistencia a los antineoplásicos son múltiples, el más importante estaría dado por una glucoproteína designada como MDR1. Esta molécula es un canal de membrana que expulsa en forma activa, o sea con consumo de ATP, al agente citotóxico desde el citoplasma hacia el espacio intersticial (fig. 4). La actividad del MDR1 se destaca particularmente en la leucemia mieloide aguda y su expresión está aumentada en el anciano (Mori M, 2011). Un terreno importante de la investigación oncológica está destinado a normatizar los métodos para dosar el MDR1 y emplearlo como blanco terapéutico.
Figura 4.
El otro aspecto es que la influencia del envejecimiento sobre la carcinogénesis se puede deber a la propia célula tumoral o al microambiente en el cual reside. Experiencias realizadas con roedores demostraron que la implantación de las mismas cepas de carcinoma de pulmón o de melanoma produjo un crecimiento más rápido, un mayor número de metástasis y una menor supervivencia en las ratas jóvenes que en las ancianas. A la inversa, la implantación de tumores de mayor capacidad inmunogénica, como los sarcomas inducidos por radiación, fue mejor tolerada en ratas jóvenes que en ratas ancianas (Ershler WB, et al., 2014).
Otro tumor cuyo comportamiento varía según la edad es el cáncer de mama y, a semejanza de los tumores previamente mencionados, la diferencia según la edad se debería a la respuesta inmunitaria. En las mujeres ancianas se observó menor infiltración de linfocitos en las biopsias obtenidas, lo que indica una respuesta inmunitaria reducida contra el tumor, en las mujeres más jóvenes, por el contrario, la respuesta inmunitaria fue mayor y esto hace progresar al tumor debido al desarrollo de factores angiogénicos segregados por las células inmunitarias (Hadar EJ, et al., 2018). Resultados similares fueron encontrados por Veronesi et al., (Veronesi U. et al., 2001) quienes observaron que 4 años después de una mastectomía parcial, sin radioterapia posoperatoria, la tasa de recidiva local en las mujeres menores de 55 años fue del 18%, mientras que, en las mujeres por arriba de esa edad, la recidiva local fue de solo el 3%.
Otra variación de la evolución de los tumores en relación con la edad se observó en el cáncer de pulmón, donde en los últimos 20 años la tasa de mortalidad se redujo en las personas menores de 60 años en relación con las personas mayores de 70 años (Weir HK, et al., 2003). Este fenómeno podría ser explicado, al menos parcialmente, por un mayor abandono del hábito de fumar en las nuevas generaciones, lo que hace retardar la aparición del cáncer de pulmón, fenómeno que además estaría asociado con una histología más favorable.
Prevención del cáncer en el anciano
Prevención primaria
La prevención primaria del cáncer incluye la eliminación de los carcinógenos ambientales. Las personas de edad avanzada, al ser más vulnerables a estos carcinógenos, son también más susceptibles a responder a estas medidas que las personas más jóvenes (Anisimov V, 2004). Los cambios epidemiológicos observados en el cáncer de pulmón, donde la incidencia aumenta en ancianos exfumadores, constituyen un blanco de acción preventiva muy importante.
Otro aspecto de la prevención primaria es el empleo de agentes que previenen determinados tipos de cáncer. Estos fármacos se utilizan para otras patologías como la osteoporosis (tamoxifeno), la hiperplasia prostática (finasterida), el acné (ácido retinoico), el dolor y los procesos inflamatorios (antiinflamatorios no esteroideos). Sin embargo, estos fármacos presentan efectos colaterales de suficiente magnitud como para que su empleo no esté indicado exclusivamente para la prevención del cáncer. Como suele haber abuso por parte de los médicos en la indicación de estos agentes, este aspecto de detalla en la tabla 3.
Tabla 3. Agentes que previenen determinados tipos de cáncer y sus respectivos efectos colaterales
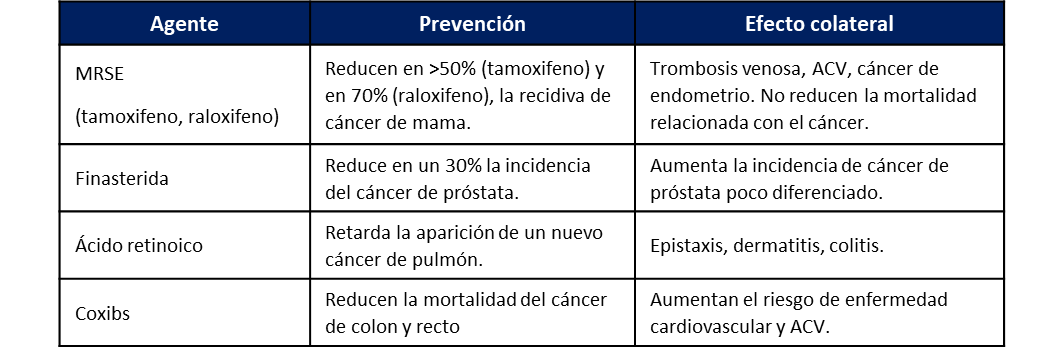
*MRSE: Moduladores de los receptores selectivos de estrógeno; ACV: Accidente cerebrovascular; Coxibs: Inhibidores selectivos de la ciclooxigenasa 2.
Experiencias con antioxidantes. Debido a una fuerte presencia de la hipótesis oxidativa del cáncer, se especuló que la suplementación de la dieta con antioxidantes podría reducir la incidencia de algunos tipos de tumores. Los estudios controlados dieron pobres resultados y en el caso del betacaroteno fueron directamente desfavorables, al menos en individuos fumadores (Hennekens CH, et al., 1996).
Resultados más promisorios se observaron con la administración de selenio, un oligoelemento que forma parte del núcleo activo de la enzima antioxidante glutatión peroxidasa (Burk RF, et al., 1993). En 1996 se publicaron los resultados del National Prevention of Cancer Study (Clark LC, et al., 1996), un estudio que incorporó a 1,250 personas de varios centros del este de los Estados Unidos, considerado como una zona pobre en selenio. El primer objetivo de este estudio fue establecer si la suplementación con selenio (200 mg/día) comparado con placebo, reducía la recidiva de cáncer de piel en individuos con alto riesgo para esta patología. Este objetivo no se cumplió, sin embargo, al cabo de 4.5 años de tratamiento y 6.5 años de seguimiento, los resultados del estudio demostraron que los pacientes aleatorizados para el grupo selenio tuvieron una reducción significativa (63%) de cáncer de próstata respecto del placebo. De hecho, el grupo que recibió selenio experimentó una menor incidencia tanto para el cáncer localizado como avanzado. Pero el estudio también demostró que los hombres con niveles iniciales bajos de selenio y a los cuales se les administró este oligoelemento, fueron los que más se beneficiaron en términos de reducción del cáncer de próstata.
Utilizando la misma población del National Prevention of Cancer Study como base metodológica, se observó luego de 10 años de seguimiento que la suplementación con selenio redujo de forma significativa la incidencia de cáncer de pulmón en los participantes que se encontraban en el tercilo más bajo de valores plasmáticos de selenio respecto de los controles (p= 0,04). (Reid ME, et al., 2012).
Prevención secundaria
Hasta el presente, la prevención secundaria sigue constituyendo el método ideal para frenar la incidencia de cáncer en el anciano. Este enfoque consiste en examinar periódicamente al individuo asintomático con riesgo de cáncer con el objeto de efectuar una detección precoz del tumor. Dicho enfoque está respaldado por la comprobación de que el cáncer puede ser detectado en una fase preclínica y de que el tratamiento en esta etapa da mejores resultados (Beghe Cl, et al., 2014).
Al efectuar estudios para el diagnóstico precoz del cáncer en personas ancianas hay que tener en cuenta la expectativa de vida y la utilidad de un determinado estudio según la edad del paciente.
La expectativa de vida. Los estudios estarían recomendados en personas cuya expectativa de vida supera los cinco años, ya que los beneficios del tratamiento se aprecian después de los cinco años del estudio inicial. En los pacientes discapacitados, con más de un síndrome geriátrico o patologías asociadas graves no se justifican los estudios para el diagnóstico precoz del cáncer (Walter LC, et al., 2011).
Edad del paciente. En ciertas situaciones, el estudio para el diagnóstico precoz del cáncer no resultaría recomendable. Por ejemplo, la mamografía para la detección precoz del cáncer de mama en mujeres mayores de 69 años es menos costo-efectiva que en mujeres más jóvenes (Kerlikowske K, et al.., 2018).
Prevención secundaria de algunos tipos de tumores
Cáncer de mama. En las mujeres entre los 50 y 70 años, la realización de 4 a 6 mamografías redujo en un 30% la mortalidad relacionada al cáncer (Kerlikowske K, et al., 2020). Por arriba de los 70 años existe controversia sobre la utilidad de la mamografía.
Cáncer del intestino grueso. Los exámenes seriados de sangre oculta en materia fecal redujeron la mortalidad por cáncer de colon y recto en las personas mayores de 50 años (Burt RW, 2000). También se observó que una colonoscopía realizada cada diez años constituye una estrategia costo-efectiva para reducir la mortalidad por este tipo de cáncer (Frazier AL, 2020). La colonoscopía y los estudios de sangre oculta no se le deben negar al paciente mayor de 80 años con más de cinco años de expectativa de vida, porque es en esta etapa donde ocurre con mayor frecuencia el cáncer de intestino grueso y porque la cirugía electiva, como se verá más adelante, no aumenta la mortalidad con la edad.
Cáncer de próstata. Hasta la edad de 75 años el estudio de marcadores como el antígeno prostático específico ha resultado ser costo-efectivo. Por arriba de esa edad existe controversia sobre su indicación (Schoder FH, et al., 2000).
Evaluación integral del paciente con cáncer
Considerando que el envejecimiento es un proceso altamente individualizado, la Sociedad Internacional de Oncología Geriátrica constituyó un grupo multidisciplinario de tareas para evaluar los numerosos problemas del anciano con cáncer, catalogar sus recursos y energía y la necesidad de asistencia. Se publicó así la “Evaluación Integral del Paciente con Cáncer” (EIPC [CGA: Comprehensive Geriatric Assessment]) (Extermann M, et al., 2005).
Para elaborar la EIPC se debieron plantear varios aspectos, los cuales se tratan a continuación.
Evidencias clínicas que permitan estratificar los grupos de riesgo en el anciano con cáncer
Uno de los objetivos de la EIPC fue establecer marcadores clínicos o biológicos que permitan predecir el grado de declinación, fragilidad y mortalidad del anciano con cáncer. Para ello la fuerza de tareas de la EIPC evaluó estudios epidemiológicos y clínicos, observando que en general los marcadores clínicos son más informativos que los biológicos.
Marcadores clínicos: La declinación funcional está considerada como un buen factor pronóstico de mortalidad precoz, y para ello se han generado evaluaciones que establecen una puntuación de declinación funcional. Estas evaluaciones se basan en la capacidad que tiene un individuo para ejercer diversas actividades cotidianas (Rockwood K, et al., 1999).
Ciertas patologías como la diabetes mellitus, la hipertensión, la enfermedad coronaria, la insuficiencia cerebrovascular y la osteoporosis, junto con adicciones como el tabaquismo, se asocian con una peor evolución en el anciano con cáncer (Rockwood K, et al., 1999). Se han desarrollado escalas de puntuación que incluyen diversos parámetros geriátricos, como el sexo masculino, la puntuación de evaluación de declinación funcional, la insuficiencia cardiaca congestiva, la pérdida injustificada de peso, un valor de creatinina en sangre >3 mg/dL y la hipoalbuminemia. (Walter LC, et al., 2001). Estos parámetros dan un riesgo general que oscila entre un 13% de mortalidad al año en la puntuación más baja, hasta un 68% en la puntuación más alta. Se publicaron también otras escalas de puntuación similares (Desai MM, et al., 2002).
La experiencia acumulada señala que la aplicación de la EIPC es útil en oncología geriátrica. Un estudio piloto en mujeres ancianas con carcinoma de mama demostró que la EIPC detectó en las pacientes diversos problemas que habían pasado inadvertidos, lo que permitió una mejor interacción con el tratamiento oncológico (Extermann M et al., 2004). Sobre la base de estas observaciones, el oncólogo médico debe tomar conciencia de que, si no aplica un método de evaluación sistematizado como es la EIPC, puede perder información útil sobre el estado de salud del paciente y esto puede impactar negativamente en el tratamiento oncológico.
Tratamiento del cáncer en el anciano
Para decidir el tratamiento que se administrará al paciente de edad avanzada se debe contemplar la expectativa de vida y la tolerancia al tratamiento, para ello es de gran utilidad la aplicación de las medidas previamente mencionadas. El tratamiento antineoplásico incluye la cirugía, la radioterapia, la quimioterapia citotóxica, el tratamiento molecular dirigido, la terapia hormonal y la terapia biológica.
Cirugía. La morbimortalidad quirúrgica aumenta después de los 70 años, pero esto se observa especialmente en la cirugía de emergencia, y dentro de ésta, en la cirugía de los tumores del abdomen. En la cirugía electiva, el aumento del riesgo por la edad es mínimo. La calidad de la anestesia constituye un importante avance, así como la posibilidad de aplicar procedimientos alternativos a la cirugía, como la ablación del tumor por radiofrecuencia (Careca I, et al., 2005).
Trabajos recientes señalan que en individuos mayores de 70 años se pueden efectuar grandes operaciones, como la del cáncer de hígado, vías biliares y páncreas, sin que aumente la morbimortalidad de forma significativa cuando se trata de procedimientos electivos (Petrowsky H, et al., 2005).
Incluso la cirugía para la resección del carcinoma de pulmón, considerada como de alto riesgo en el anciano, se puede llevar a cabo con una baja morbimortalidad cuando se la programa electivamente. Matsuoka et al., operaron a 40 pacientes de 80 o más años de carcinoma pulmonar de células no pequeñas, con resección completa del tumor (Matsuoka et al., 2005). Las operaciones realizadas fueron: lobectomías 40%, segmentectomías 30% y resecciones en cuña 30%, sin tener mortalidad quirúrgica a pesar de que el 20% de los pacientes presentaba patologías asociadas graves. La tasa de supervivencia fue del 92% al año y del 57% a los cinco años. La experiencia de éste y otros autores señala que la edad como elemento aislado no es un factor de riesgo en la cirugía oncológica, sino que las patologías asociadas graves y la cirugía de urgencia son los que constituyen factores determinantes en la morbimortalidad posoperatoria (Marusch F, et al., 2005).
Radioterapia
Según estudios retrospectivos sobre grandes series de pacientes, la radioterapia externa dirigida es bien tolerada, incluso en pacientes mayores de 80 años, y alrededor del 90% logra completar el tratamiento (Balducci L, et al., 2004). El aporte nutricional es importante en los pacientes que reciben radioterapia torácica o de las vías respiratorias superiores y cuando hay gran riesgo de obstrucción a nivel del esófago, puede ser necesaria algún tipo de gastrostomía. En el tratamiento del cáncer de próstata, la braquiterapia o colocación de semillas radiactivas en la glándula prostática es un procedimiento seguro y eficaz (Zachariah B, et al., 2000).
Consideraciones especiales para el paciente anciano que recibe quimioterapia citotóxica
En el anciano suele haber un cierto grado de deterioro de los tejidos encargados de absorber, metabolizar y excretar los fármacos oncológicos. Además, el daño colateral a los tejidos sensibles a la quimioterapia es mayor en el anciano que en los adultos jóvenes. Hay alteraciones en la absorción y el metabolismo hepático que disminuyen o aumentan la eficacia de una droga. Un factor importante para tener en cuenta es la reducción progresiva de la tasa de filtrado glomerular renal, que es casi constante en el envejecimiento, y esto puede aumentar la semivida de algunos agentes que se eliminan preferentemente por el riñón (carboplatino, bleomicina, metotrexato, capecitabina, fludarabina) (Cova D, et al., 2004).
Por lo tanto, hay tres aspectos a considerar: los cambios en la farmacocinesis, en la farmacodinamia y la susceptibilidad de los tejidos a los agentes administrados (Balducci L, et al., 2005).
Farmacocinesis: Si la absorción en el tubo digestivo está reducida, puede haber una respuesta insuficiente al fármaco. En cambio, si lo que está reducido es la depuración plasmática renal, o el catabolismo hepático, la toxicidad del fármaco aumentará. En ambos casos se debe ajustar la dosis en menos o en más según la situación.
La captación hepática de un medicamento disminuye con la edad, debido a una menor circulación esplácnica, menor número de hepatocitos y una reducción de la actividad del citocromo P450, una proteína cuya función es la de metabolizar diversos xenobióticos y agentes farmacológicos. También se puede producir una inadecuada distribución del agente hidrosoluble por una volemia reducida, por hipoalbuminemia o por hipoglobulinemia. Este aspecto es importante, ya que muchos fármacos son transportados en la sangre unidos a la albúmina y a la hemoglobina (Balducci L, et al., 2005).
Farmacodinamia: Puede haber una disminución de la tasa de reparación del ADN o un menor catabolismo intracelular del fármaco (Rudd GN, et al., 1995).
Mayor susceptibilidad de los tejidos al agente citotóxico: Los más afectados son el tejido hematopoyético, la mucosa digestiva, el corazón y el sistema nervioso periférico. El daño al tejido hematopoyético aumenta con el envejecimiento y determina que el paciente sea proclive al riesgo de infecciones por neutropenia o que desarrolle anemia y trombocitopenia. Cualquiera de estas circunstancias aumenta el tiempo de hospitalización del enfermo (Morrison VA, et al., 2001). Se ha observado que la mayoría de las infecciones y las muertes por infecciones ocurren durante la primera etapa del tratamiento (Zinzani PG, et al. 1999). En el anciano con neutropenia, el filgrastim, un agente que actúa como factor estimulante de colonias de granulocitos humanos, ha producido excelentes resultados, con un 40% de reducción del riesgo de neutropenia febril (Chrischilles E, et al., 2002).
No se recomienda la práctica de reducir la dosis de quimioterapia. En varios estudios prospectivos de pacientes con linfoma o cáncer de mama se observó que la reducción de las dosis produjo un aumento en la tasa de recidivas y una disminución de la supervivencia (Valagussa P, et al., 1994).
En el tubo digestivo, la destrucción de la mucosa produce disfagia, diarrea y deshidratación. Los ancianos son muy proclives a la mucositis, especialmente cuando reciben tratamientos con pirimidinas fluorinadas (Jacobson SD, et al., 2001).
En el corazón se puede desarrollar una miocardiopatía en los casos en que se utilizan las antraciclinas. La doxorrubicina, que pertenece a la familia de las antraciclinas, ejerce su toxicidad sobre el miocardio y produce una miocardiopatía inespecífica, con vacuolización de células miocárdicas y dilatación de mitocondrias. Este efecto tiene como consecuencia un deterioro progresivo de la contractilidad miocárdica al ir aumentando la dosis acumulativa de antraciclinas, con producción de disfunción ventricular (Nousiainen T, et al., 2001).
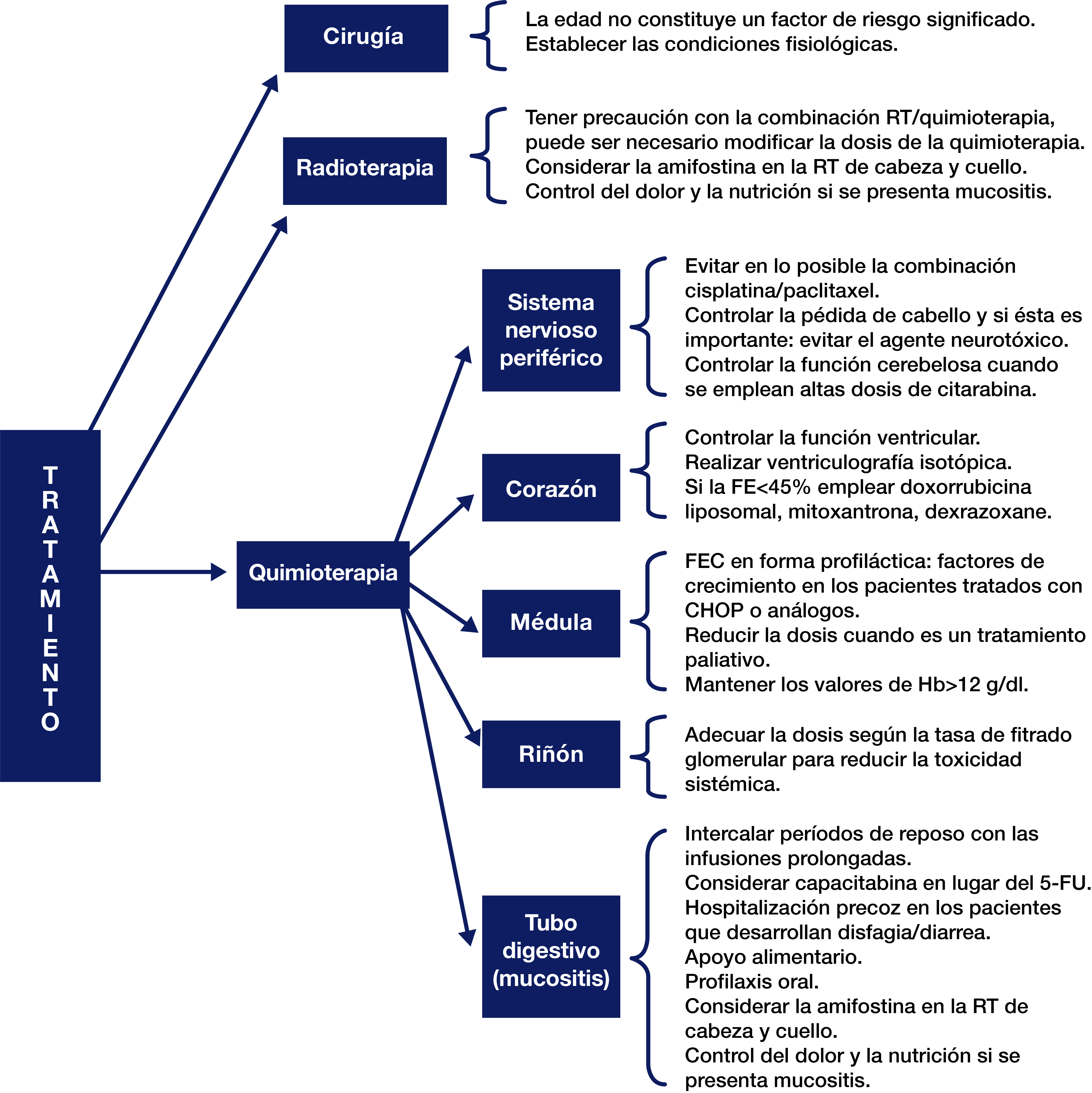
En el sistema nervioso periférico algunos agentes producen neuritis y la mejor estrategia es la prevención, evitando la combinación de agentes neurotóxicos como el cisplatino y el paclitaxel, e interrumpir el tratamiento cuando progresa la neuropatía (Cova D, et al., 2004) (fig. 5). El 2005 National Comprehensive Cancer Network estableció una serie de recomendaciones que se resumen en la fig. 5.
Figura 5.
Tratamiento del dolor
El anciano con cáncer suele tener muchas aprensiones y miedos en lo concerniente al dolor, tales como: considera que el dolor es parte necesaria de la enfermedad; teme molestar al médico insistiéndole sobre el dolor; miedo a la adicción; miedo a que le reduzca la función cognitiva; y miedo a que al manifestar dolor se le prolongue el tiempo de hospitalización. También hay razones económicas para que el paciente no quiera consumir la cantidad necesaria de analgésicos (Balducci L, 2003).
Surge de todos estos aspectos que el tratamiento del dolor en el anciano con cáncer sea diferente al de individuos jóvenes y suela recibir menos medicación de la necesaria, pero el médico, la familia y el personal encargado de cuidar al paciente debe saber que el dolor en el anciano se puede controlar y se debe tratar, ya que el paciente tiene derecho a la mejor calidad de vida posible.
En el anciano es preferible el paracetamol a los antiinflamatorios no esteroides, porque supone menor riesgo de complicaciones renales y gastrointestinales. En cuanto a los opioides, como la morfina y la hidromorfona, que comparten la misma farmacología, el riñón es el encargado de eliminar los metabolitos responsables de la actividad analgésica y de algunos efectos colaterales. Por lo tanto, es necesario conocer el estado del filtrado glomerular para evitar un aumento de la semivida en el plasma de estos agentes. Con los opioides se debe ir ajustando la dosis y, en la medida de lo posible, utilizar agentes o métodos de liberación prolongada (Balducci L, 2003).
Bibliografía:
Dr. Adrián P. Huñis
Oncólogo Médico
Miembro Emérito de ASCO
Miembro Emérito de ESMO
¿No tienes una cuenta? Regístrate