Pirtobrutinib reflejó una efectividad en el tratamiento de neoplasias hematológicas, respaldada por resultados de la tasa de respuesta global (TRG) y la duración de la respuesta (DoR por sus siglas en inglés) en pacientes con leucemia linfocítica crónica (LLC) o linfoma linfocítico pequeño (LLP)
El 1 de diciembre, Eli Lilly and Company anunció que la FDA aprobó pirtobrutinib para pacientes adultos con LLC o LLP que habían recibido al menos dos líneas de terapia previas, incluida la tirosina quinasa de Bruton (BTK por sus siglas en inglés) y un inhibidor de BCL-2. La aprobación se basó en los resultados de la TRG y la DoR del estudio clínico BRUIN de fase I/II. La aprobación está sujeta a la verificación y descripción del beneficio clínico en un estudio confirmatorio, según lo establecido por la FDA.
La aprobación se basó en datos de un subconjunto de pacientes en el estudio BRUIN. La evaluación de la eficacia se llevó a cabo en 108 pacientes con LLC/LLP tratados con pirtobrutinib, que recibieron al menos dos líneas previas de terapia, incluyendo un inhibidor de BTK y un inhibidor de BCL-2.
La dosis administrada fue de 200 mg de pirtobrutinib una vez al día, continua hasta la progresión de la enfermedad o hasta la aparición de toxicidad inaceptable. Se excluyeron pacientes con afectación activa del sistema nervioso central o trasplante alogénico de células madre hematopoyéticas en los últimos 60 días.
La población elegible para la evaluación de eficacia había recibido en promedio cinco líneas de tratamiento previas, siendo los inhibidores de BTK más comunes ibrutinib (97%), acalabrutinib (9%) y zanubrutinib (0,9%). El 77% de los pacientes interrumpieron el último inhibidor de BTK debido a enfermedad refractaria o progresiva. La eficacia se estableció en función de la TRG y la DoR, según la evaluación de un comité de revisión independiente.
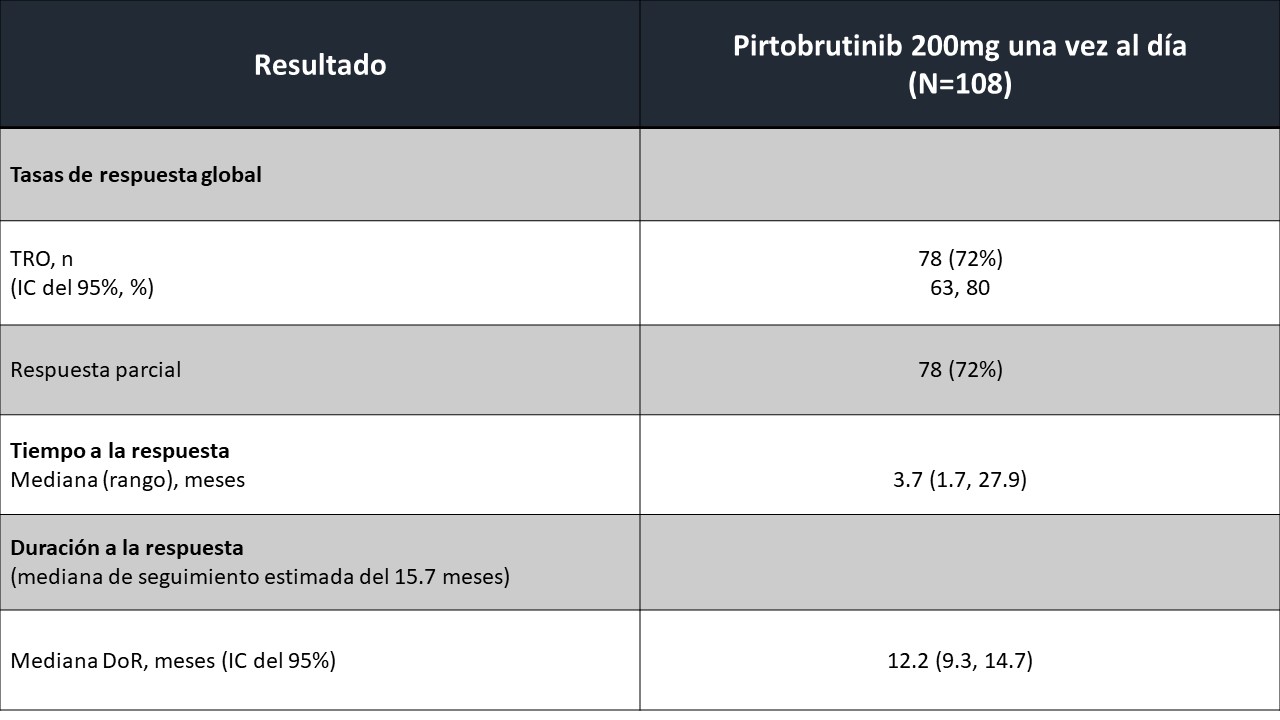
Los resultados de la eficacia fueron los siguientes:
El análisis de seguridad en el estudio BRUIN incluyó a 593 pacientes con neoplasias hematológicas tratados con 200 mg de pirtobrutinib al día como monoterapia.
Los eventos adversos (EA) más comunes, en un 20% o más de los pacientes, incluyeron: disminución de neutrófilos, hemoglobina, linfocitos, plaquetas, fatiga, dolor musculoesquelético, diarrea, COVID-19, hematomas y tos.
La seguridad se evaluó en pacientes expuestos a pirtobrutinib durante uno o dos años, resultando en reducciones de dosis en el 3.6%, interrupción del tratamiento en el 42%, y discontinuación permanente en el 9% de los pacientes. Los EA graves se observaron en el 56% de los pacientes, siendo más del 5% para neumonía, COVID-19, sepsis y neutropenia febril.
Acerca del estudio BRUIN
Estudio clínico, fase I/II, multicéntrico, mundial, con pirtobrutinib para pacientes con neoplasias hematológicas, LLC, LLP y linfoma de células del manto. El objetivo primario del estudio fase I es la dosis máxima tolerada/dosis recomendada de la fase II. Los objetivos secundarios fueron la seguridad, farmacocinética y eficacia preliminar medida por la TRG para la monoterapia. El objetivo primario del estudio fase Ib es la seguridad de las combinaciones de medicamentos. Los objetivos secundarios fueron la farmacocinética y la eficacia preliminar medida por la TRO para las combinaciones de medicamentos. El objetivo primario del estudio fase II es la TRO según lo determinado por un comité de revisión independiente. Los objetivos secundarios fueron la TRO determinada por el investigador, la mejor respuesta global, la DoR, la supervivencia libre de progresión, la supervivencia global, la seguridad y la farmacocinética.
Fuente consultada:
Jaypirca® (pirtobrutinib) Now Approved by U.S. FDA for the Treatment of Adult Patients with Chronic Lymphocytic Leukemia or Small Lymphocytic Lymphoma Who Have Received at Least Two Lines of Therapy, Including a BTK Inhibitor and a BCL-2 Inhibitor. https://investor.lilly.com/news-releases/news-release-details/jaypircar-pirtobrutinib-now-approved-us-fda-treatment-adult. Comunicado de prensa. Acceso el 4 de diciembre de 2023.
Noticia redactada por Karem Vázquez
Para aclaraciones y comentarios contactar al correo [email protected]
¿No tienes una cuenta? Regístrate