
La supervivencia libre de progresión aumentó significativamente con olaparib más bevacizumab como terapia de mantenimiento en general y en subgrupos preespecificados.
Las pacientes con cáncer de ovario recién diagnosticado demostraron una supervivencia libre de progresión (SLP) significativamente mayor con la adición de olaparib al tratamiento de mantenimiento con bevacizumab, en comparación con bevacizumab, el estándar de atención, después de la quimioterapia de primera línea basada en platino según los hallazgos del estudio fase III PAOLA-1/ENGOT-ov25 presentado en el Congreso ESMO 2019 en Barcelona, España.
Isabelle L. Ray-Coquard del Medical Oncology, Centre Léon Bérard en Lyon, grupo GINECO de Francia, presentó los resultados del ensayo PAOLA-1 / ENGOT-ov25, que evaluó la eficacia y seguridad de olaparib en la formulación de tabletas en pacientes con diagnóstico reciente de cáncer de ovario avanzado.
PAOLA-1 / ENGOT-ov25 fue un estudio aleatorizado, doble ciego, internacional de fase III (NCT02477644) que inscribió a pacientes de reciente diagnóstico, estadio FIGO III – IV con cáncer de ovario seroso o endometrioide de alto grado, trompa de Falopio o cáncer peritoneal primario.
Las pacientes en respuesta clínica completa o parcial después de la quimioterapia basada en platino más bevacizumab fueron aleatorizados 2: 1 para recibir olaparib oral a 300 mg dos veces al día durante hasta 24 meses o placebo más bevacizumab a 15 mg / kg en el primer día cada 3 semanas durante 15 meses, que incluyeron dosis recibidas durante la quimioterapia. Los pacientes fueron estratificados por el resultado del tratamiento de primera línea y la mutación BRCA del tumor.
El objetivo primario fue la SLP evaluada por el investigador de acuerdo con RECIST v1.1 en la población por intención de tratar (ITT).
La mediana de seguimiento fue de 24.0 meses para 537 pacientes en el brazo de olaparib y 22.7 meses para 269 pacientes en el brazo de placebo.
El análisis de los datos con una madurez del 59% demostró una mediana de SLP de 22.1 meses con olaparib en comparación con 16.6 meses con placebo ( [HR] 0.59; intervalo de confianza [IC] del 95%, 0.49-0.72; p <0.0001).
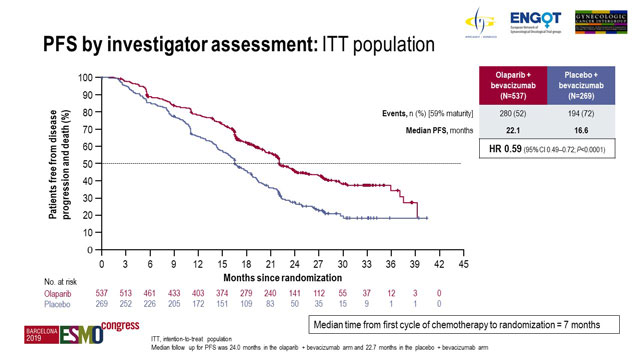
SLP por evaluación del investigador: población ITT.
© Isabelle L. Ray-Coquard.
Los pacientes con mutación tumoral BRCA y pacientes con HRD-positivo obtuvieron un beneficio superior de SLP con olaparib
También se presentaron los resultados de los análisis de subgrupos preespecificados. Con respecto a los pacientes estratificados por el estado de mutación BRCA, 237 pacientes tenían mutación BRCA tumoral y 569 pacientes tenían mutación BRCA no tumoral.
Entre los pacientes con mutación tumoral BRCA, la mediana de SLP con tratamiento con olaparib fue de 37.2 meses en comparación con 21.7 meses con placebo (HR 0,31; IC del 95%: 0,20-0,47). Los pacientes con mutación BRCA no tumoral demostraron una mediana de SLP de 18.9 meses con olaparib versus 16.0 meses con placebo (HR 0.71; IC 95%, 0.58-0.88).
El análisis según el estado de HRD mostró que 387 pacientes eran HRD-positivos; de estos 152 eran BRCA no tumorales. El estado de HRD fue negativo o desconocido para 419 pacientes.
En pacientes con HRD-positivo, la mediana de SLP con olaparib fue de 37.2 meses en comparación con 17.7 meses con placebo (HR 0.33; IC 95%, 0.25-0.45). La mediana de SLP en pacientes BRCA no tumorales con HRD-positivos tratados con olaparib fue de 28.1 meses versus 16.6 meses con placebo (HR 0.43; IC 95%, 0.28-0.66). Olaparib tuvo poco efecto en pacientes que no eran HRD-positivos; en pacientes con un estado HRD negativo o desconocido, la mediana de SLP fue de 16.9 meses versus 16.0 meses con olaparib versus placebo (HR 0.92; IC 95%, 0.72-1.17).
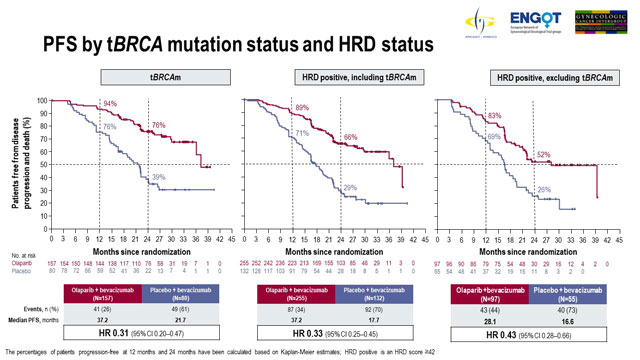
SLP por estado de mutación tBRCA y estado HRD.
© Isabelle L. Ray-Coquard.
Los datos sobre PFS2 no estaban maduros en el momento de este análisis.
Los eventos adversos de grado ≥ 3 (EA) ocurrieron en 57% versus 51% de los pacientes que recibieron olaparib y placebo. Los efectos adversos notificados con mayor frecuencia fueron hipertensión (19% versus 30%) y anemia (17% versus <1%).
Hubo cinco EA emergentes de tratamiento fatal, uno con olaparib y 4 en el brazo de placebo. Las interrupciones de la dosis ocurrieron en 54% versus 24%, las reducciones de dosis ocurrieron en 41% versus 7%, y la interrupción del tratamiento ocurrió en 20% versus 6% de los pacientes que recibieron olaparib y placebo, respectivamente.
Aunque las interrupciones del tratamiento, las reducciones y las interrupciones ocurrieron con mayor frecuencia con olaparib, no se observaron diferencias clínicamente significativas en la calidad de vida relacionada con la salud entre los brazos de tratamiento.
Conclusiones
PAOLA-1 / ENGOT-ov25 cumplió su objetivo principal, demostrando una mejora estadísticamente significativa y clínicamente significativa en la SLP en la población de ITT cuando se agregó olaparib en comparación con placebo al tratamiento de mantenimiento de bevacizumab estándar de primera línea. El beneficio de la SLP en subgrupos de pacientes con mutación tumoral BRCA y en pacientes con HRD positivo fue sustancial.
Según los autores, este es el primer ensayo de fase III para evaluar la eficacia y la seguridad de un inhibidor de PARP más bevacizumab como terapia de mantenimiento de primera línea en el cáncer de ovario avanzado no restringido por el resultado quirúrgico o el estado de mutación BRCA.
¿No tienes una cuenta? Regístrate